▼NGSに基づく包括的遺伝子診断5) ▼実臨床におけるリキッドバイオプシーの活用7)
非小細胞肺がん(NSCLC)患者の遺伝子診断
-実臨床における次世代シークエンス(NGS)・リキッドバイオプシーの活用-
がん医療で展開されている「プレシジョン・メディシン(精密医療)」には、遺伝子診断が欠かせません。近年開発が進められている、次世代シークエンス(NGS)に基づく包括的ゲノムプロファイリング(CGP)は短時間でロングリードのDNAを解析し、複数のバイオマーカーを検出できることから、実臨床において重要な役割を果たしています。
また、現在の遺伝子診断用の標準的手法は組織生検ですが、検体に含まれる腫瘍の不均一性や生検時の合併症などの問題から1-3)、組織生検を補完・代替する方法としてリキッドバイオプシーが注目されています。非小細胞肺がん(NSCLC)領域に関しては、薬剤によっては治療開始時だけでなく、治療中における新たな遺伝子変異の出現を常にモニタリングする場合もあり4)、侵襲度の高い肺生検に替わる手法として高い期待が寄せられています。
今回は、がん医療の実臨床におけるNGSとリキッドバイオプシーの有用性について報告された論文をご紹介します。
NGSに基づく包括的遺伝子診断5)
NGSは、全ゲノムシークエンス(WGS)、全エクソンシークエンス(WES)、ターゲットシークエンス(TS)の3種類に大別されます。FoundationOne CDx(F1CDx)はTSベースのシステムであり、ホルマリン固定パラフィン包埋(FFPE)標本から得られたDNAを用いて、324遺伝子の塩基置換、挿入/欠失、コピー数異常および遺伝子再編成などの変異を同定するとともに、マイクロサテライト不安定性(MSI)や腫瘍遺伝子変異量(TMB)などのゲノムシグネチャーを検出することができます6)。
実臨床におけるF1CDxの有用性を評価したイタリアの後ろ向き研究では、FFPE標本122検体が解析され、そのうち105検体(86.06%)では検体発送からレポート作成までが14日以内で完了しました。解析成功率は68.85%(84検体)で、解析の成功にはFFPE標本の種類(ブロックまたはスライド)、検体の採取方法(手術または生検)、固定の期間(5年未満または5年以上)などが影響することが報告されました。検出された遺伝子変異はシグナル伝達経路別に、RAS、WNT/APC、相同組換え修復、RTK、PI3K/PTEN/AKT/mTOR、ホルモン受容体、MMR、アポトーシス制御、転写制御、細胞周期制御、クロマチンリモデリング、RNA maturation、血管新生、JAK/STAT、TGF-β経路、TP53、SRC、RBなどに分類され、NSCLCではRASシグナル伝達経路、クロマチンリモデリングに関連する遺伝子が高頻度で変異していました(図1)。
本研究では、全身状態が良好で(PS1以下)、承認された治療法がない患者や既存の治療法に耐性を示す患者においては、F1CDxを用いたCGP検査の有用性が高いと述べられています。また、CGPにより患者ごとに腫瘍バイオロジーを明らかにすることができ、これは革新的な治療法の開発や、前治療に対する感受性や抵抗性のメカニズム解明に繋がる可能性があると考察されています。
図1 代表的な腫瘍における遺伝子変異パターン
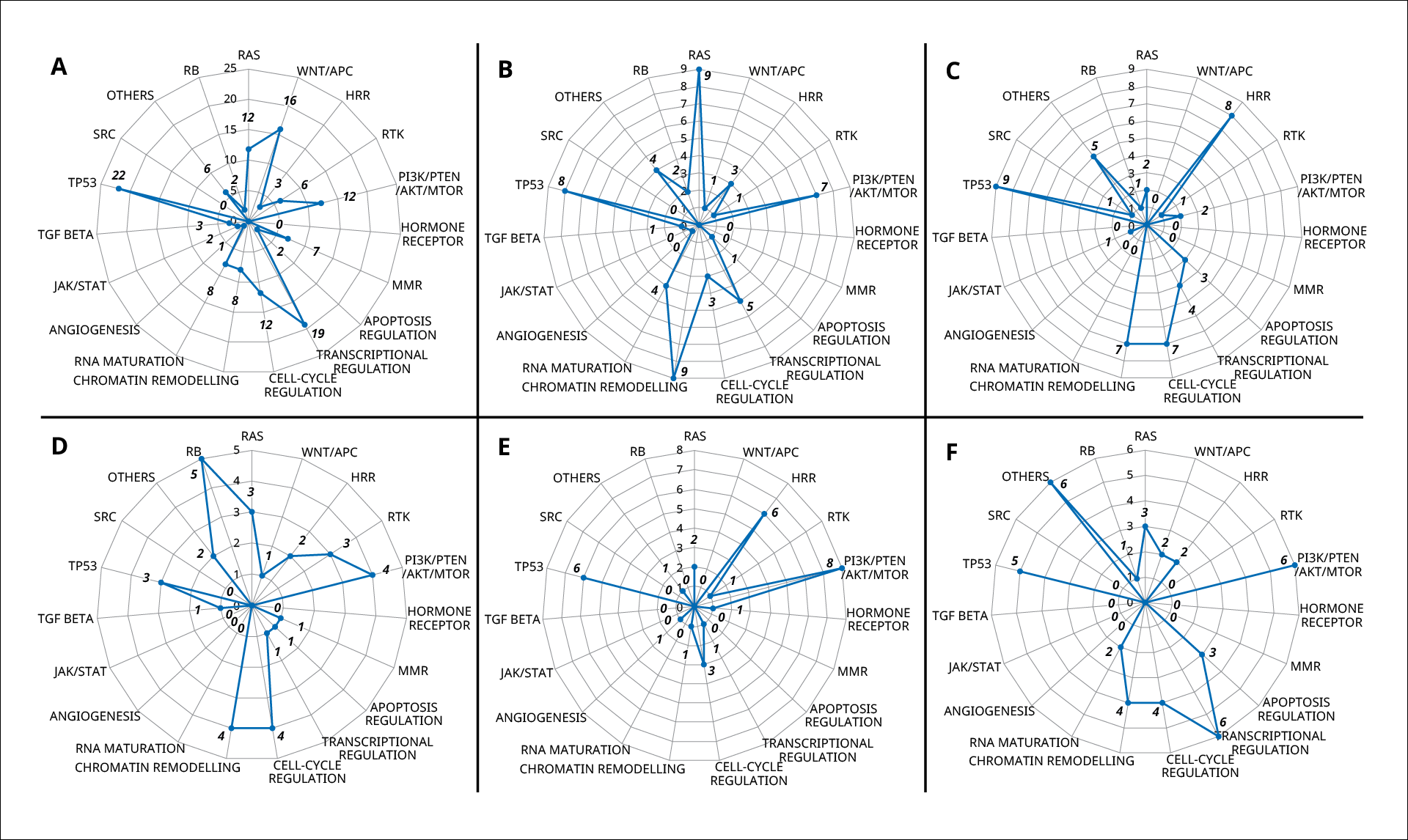
6種類の代表的な腫瘍で検出された遺伝子変異の頻度をシグナル伝達経路別にまとめたレーダーチャート。A)大腸がん、B)NSCLC、C)卵巣がん、 D)胆道がん、E)乳がん、F)胃がん。TGF-β:トランスフォーミング増殖因子β
出典:文献5
実臨床におけるリキッドバイオプシーの活用7)
2020年、進行NSCLCにおける組織検体とリキッドバイオプシー検体のNGSを比較した初のシステマティックレビューが報告されました。解析対象は、1,141例から採取した組織検体およびリキッドバイオプシー検体をマッチングさせた2,000の遺伝子変異です。ガイドラインで遺伝子診断が推奨されている遺伝子変異について、リキッドバイオプシー検体と組織検体の陽性一致率は、ALK 53.6%(45/84)、BRAF 53.9%(14/26)、ERBB2(HER2)56.5%(13/23)、EGFR 67.8%(428/631)、KRAS 64.2%(122/190)、MET 58.6%(17/29)、RET 54.6%(12/22)、ROS1 53.3%(8/15)などで、リキッドバイオプシーによる突然変異の検出能力は組織検体ほど高くはない結果でした(図2)。これは、ほとんどの遺伝子において、信頼性の高い結論を導き出すのに十分な検体数が得られなかったためと考察されています。また、本研究には「解析に用いられたNGSパネルが文献間で異なる」「文献の発表時期に応じてNGSの検出感度・特異度が異なる」「文献によってはリキッドバイオプシー検体と組織検体の採取時期が離れている」等のlimitationがあり、これらも突然変異の検出能力に影響を及ぼしたと推察されます。
本研究では、現時点においてリキッドバイオプシーは組織生検の代替手法ではないという結論に至りました。しかし、リキッドバイオプシーと組織生検を同時に行うことで、遺伝子変異の検出能力が増し、より多くの患者を分子標的薬で治療できるようになる可能性があります8-9)。
図2 遺伝子ごとの変異陽性一致率(累積)
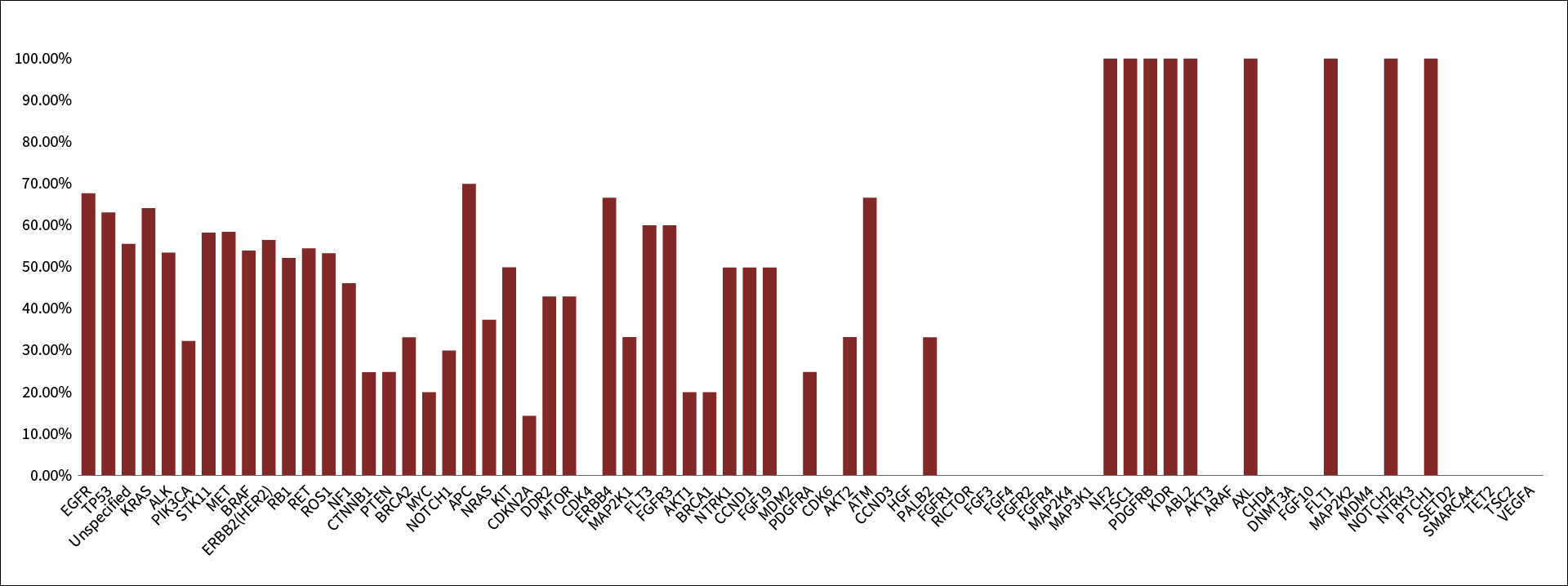
棒グラフは最終解析に相当する全試験の遺伝子ごとの変異陽性一致率(累積)を示す。
出典:文献7
文献
1) Overman MJ, et al. J Clin Oncol. 2013;31(1):17-22.
2) Heerink WJ, et al. Eur Radiol. 2017;27(1):138-148.
3) Toor OM, et al. Mol Cancer Ther. 2018;17(5):1123-1132.
4) Mok TS, et al. N Engl J Med. 2017;376(7):629-640.
5) De Falco V, et al. ESMO Open. 2020;5(2):e000675.
6) Frampton GM, et al. Nat Biotechnol. 2013;31(11):1023-1031.
7) Esagian SM, et al. J Cancer Res Clin Oncol. 2020;146(8):2051-2066.
8) Leighl NB, et al. Clin Cancer Res. 2019;25(15):4691-4700.
9) Aggarwal C, et al. JAMA Oncol. 2019;5(2):173-180.